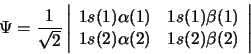Puntuación:

- Cada respuesta correcta suma 1/2 punto.
- Cada respuesta incorrecta (o múltiple) resta 1/6 punto.
- Cada pregunta no contestada no puntúa.
Resulta conveniente contestar solamente aquellas preguntas cuya
respuesta se conozca con seguridad. Sólo hay una respuesta correcta en
cada pregunta.
En la hoja de respuestas no olvidéis rellenar:
- NOMBRE Y APELLIDOS.
- DNI.
- MODELO (Importante: toda hoja de respuestas sin modelo
equivale a un suspenso).
- La función de onda
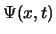 , solución de la ecuación de Schrödinger dependiente del tiempo,
se puede factorizar como el producto de una función espacial por otra que depende del tiempo:
, solución de la ecuación de Schrödinger dependiente del tiempo,
se puede factorizar como el producto de una función espacial por otra que depende del tiempo:
- Si la energía potencial del sistema es dependiente del tiempo.
- Si la energía cinética es constante.
- Si el momento lineal es constante.
- Si la energía potencial es independiente del tiempo.
- La función de onda que describe un sistema sometido a un potencial
finito tiene que ser:
- Monovaluada, continua y de cuadrado integrable.
- Solamente monovaluada y continua.
- Solamente monovaluada y de cuadrado integrable.
- Bivaluada.
- El conmutador entre los operadores mecanocuánticos de posición (
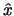 )
y de momento lineal (
)
y de momento lineal (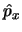 ),
),
![$\left[ \hat{x}, \hat{p}_x \right]$](img6.gif) :
:
- Vale
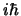
- Vale 0
- Vale
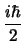
- No tiene un valor preciso, el principio de incertidumbre de Heisenberg lo impide.
- La probabilidad de que una partícula con energía cinética
dada (
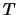 ) atraviese por efecto túnel una barrera de energía potencial
) atraviese por efecto túnel una barrera de energía potencial
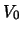 , tal que
, tal que 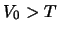 y de anchura
y de anchura 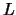 :
:
- Es nula.
- Aumenta al aumentar la altura de la barrera
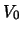 .
.
- Aumenta al aumentar la anchura de la barrera
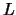 .
.
- Aumenta al disminuir la masa de la partícula.
- ¿Cuál de las siguientes afirmaciones es cierta?
- La posición y el momento lineal de una partícula pueden conocerse con total precisión
en determinadas circunstancias si se dispone del instrumental experimental adecuado.
- La posición o el momento lineal de una partícula nunca se pueden medir.
- La naturaleza ondulatoria de la materia conduce a imprecisiones en la medida simultánea
de la posición y el momento lineal de una partícula.
- El principio de incertidumbre de Heisenberg es una consecuencia de la mecánica clásica relativista,
en concreto del hecho de que
 .
.
- La función trabajo de un metal vale 2.5 eV. Se puede extraer un electrón mediante el
efecto fotoeléctrico si se hace incidir sobre el metal:
- Un fotón de energía 1.8 eV.
- Dos fotones de energía 1.8 eV cada uno.
- Un número suficientemente grande de fotones, independientemente de su energía.
- Un fotón de energía 2.6 eV.
- El módulo del momento angular de un electrón en el átomo de hidrógeno
cuando está descrito por el orbital
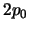 y cuando está descrito por el orbital
y cuando está descrito por el orbital 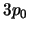 :
:
- Es el mismo en ambos casos y vale
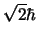 .
.
- Es distinto en un caso que en otro, y vale
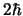 y
y 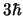 , respectivamente.
, respectivamente.
- Es el mismo en ambos casos y vale
 .
.
- Es el mismo en ambos casos y vale 0.
- De los niveles de energía estacionarios de una partícula en una caja monodimensional
de longitud
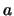 , caracterizados por el número cuántico
, caracterizados por el número cuántico 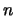 , se puede decir que:
, se puede decir que:
- Están equiespaciados sea cual sea el valor de
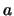 .
.
- El estado fundamental tiene energía cero.
- Su energía es proporcional a
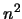 , donde
, donde
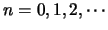 y crece con la longitud de
la caja.
y crece con la longitud de
la caja.
- Su energía es proporcional a
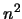 , donde
, donde
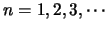 y disminuye con la longitud de
la caja.
y disminuye con la longitud de
la caja.
- En átomos hidrogenoides las energías orbitales son:
- Función de los números cuánticos
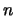 y
y  .
.
- Función sólo del número cuántico
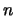 .
.
- Directamente proporcionales al número cuántico
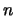 .
.
- Directamente proporcionales al número cuántico
 .
.
- La función de onda para el estado fundamental de un oscilador armónico
monodimensional es de la forma
- La densidad de probabilidad de encontrar a la partícula es máxima en
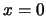 .
.
- La densidad de probabilidad de encontrar a la partícula es nula en
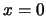 .
.
- La función es mínima en
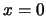 .
.
- La función toma distinto valor en los puntos
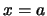 y
y 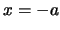 .
.
- Un electrón de un átomo hidrogenoide en un estado enlazado descrito por la función de onda
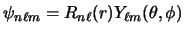 tiene una densidad de
probabilidad radial (o función de distribución radial) proporcional a:
tiene una densidad de
probabilidad radial (o función de distribución radial) proporcional a:
-
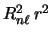
-
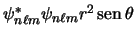
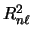
-
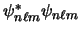
- La función de onda
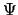 de un sistema dado debe normalizarse:
de un sistema dado debe normalizarse:
- Para que se cumpla que
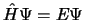 .
.
- Para que
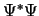 sea una densidad de probabilidad.
sea una densidad de probabilidad.
- Para que se cumpla que
 .
.
- Para que
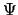 sea continua.
sea continua.
- Los números cuánticos correspondientes al siguiente orbital de un átomo de hidrógeno
son:
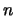 = 1,
= 1,  = 1,
= 1, 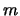 = 1
= 1
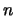 = 2,
= 2,  = 1,
= 1, 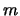 = 0
= 0
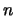 = 2,
= 2,  = 1,
= 1, 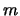 = 1
= 1
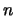 = 3,
= 3,  = 0,
= 0, 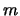 = 0
= 0
- ¿Cuál de las siguientes funciones es antisimétrica respecto
al intercambio de electrones?
-
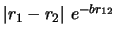
-
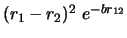
-
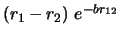

- El primer estado excitado de una caja cuadrada de lado
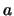 :
:
- Tiene energía
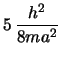 y degeneración 2
y degeneración 2
- Tiene energía
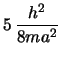 y degeneración 3
y degeneración 3
- Tiene energía
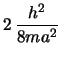 y degeneración 2
y degeneración 2
- Tiene energía
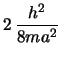 y no está degenerado.
y no está degenerado.
- El término espectral fundamental para el átomo de Ti ([Ar]
 ) es:
) es:

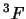
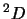
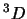
- El hamiltoniano completo de la molécula de LiH
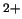 , donde los subíndices 1 y
2 denotan los electrones, es:
, donde los subíndices 1 y
2 denotan los electrones, es:
-
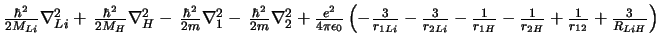
-
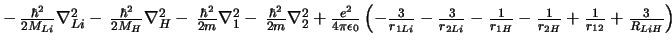
-
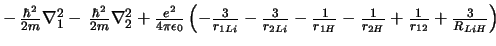
-

- Para el átomo de He, la función
- Es la única función de onda válida para cualquier estado electrónico del He.
- Es una solución exacta de la ecuación de Schrödinger independiente del tiempo.
- Describe una función de onda aproximada para el estado fundamental del He en la aproximación orbital.
- Se anula ya que hay dos filas iguales.
- La aproximación de Born-Oppenheimer se basa en el hecho de que:
- los núcleos no se mueven nunca.
- los núcleos se mueven más rápidamente que los electrones.
- los electrones se mueven mucho más rápidamente que los núcleos.
- los núcleos enlazados para formar moléculas no se mueven.
- Considérese un átomo polielectrónico.
- Sólo se puede tener un estado para cada configuración electrónica.
- Todas las configuraciones electrónicas dan lugar al mismo número de estados.
- Dada una configuración electrónica, se puede saber el número de estados a los que da lugar.
- El número de estados provenientes de una configuración electrónica es siempre mayor que uno.
© Copyright.
Alfredo Aguado
2005-07-11


 .
.
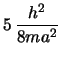 y degeneración 2
y degeneración 2
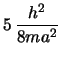 y degeneración 3
y degeneración 3
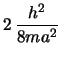 y degeneración 2
y degeneración 2
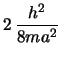 y no está degenerado.
y no está degenerado.