Solución: 1.986 10
Solución: (a) UV de vacío; (b) rayos X; (c) radio; (d) IR.
Solución: 36%.
Solución:
siendo
con
Solución:
Solución: B = 0.3572 cm
Solución: (a) r = 1.131 10
Solución: n
Solución: B = 20.57 cm
Solución: I = 1.889 10
Solución: I
Solución:
Solución:
Solución:
Solución: J(0
Solución:
Solución:
Solución:
Solución: (a)
Solución:
Solución:
Solución: (a) x
Solución: (a)
Solución: (a)
Solución:
Solución: (a)
Solución: (a) 1, (b) 4, (c) 3, (d) 30.
Solución: lineal ABB o lineal ABC.
Solución: ABB
Solución: 0.36 de la fundamental.
Solución:
|
|
|||
| 0 | 1 | 115261.2 | |
| 1 | 2 | 230543.0 | |
| 2 | 3 | 345812.9 | |
| 3 | 4 | 461083.7 | |
| 4 | 5 | 576354.8 | |
Solución:
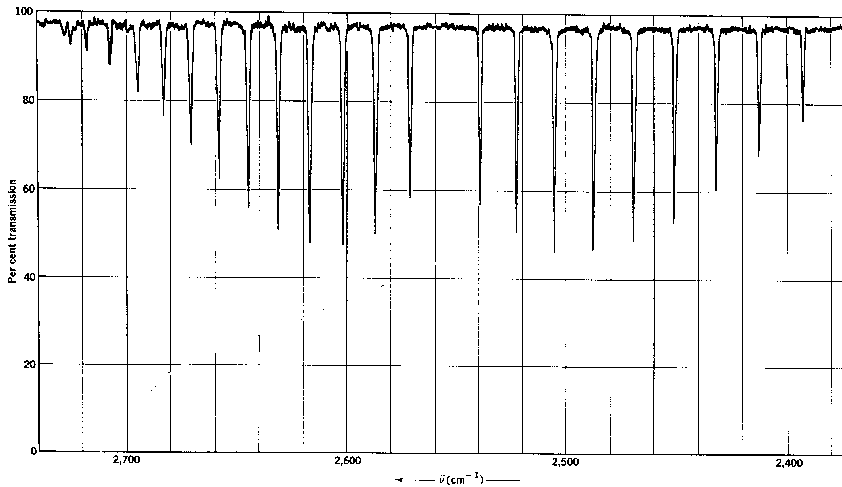
Solución:
Solución: 1
Solución:
| cm |
Infrarrojos | Raman | |
| 3756 | Muy fuerte; perpendicular | - | |
| 3652 | Fuerte; paralela | Fuerte; polarizada | |
| 1595 | Muy fuerte; paralela | - | |
La estructura fina rotacional de las bandas de infrarrojos
es compleja y no muestra las características simples PR o
PRQ. Comentar la estructura molecular y asignar las líneas
observadas a vibraciones moleculares concretas en la medida
de lo posible.
Solución: No lineal. 3756 cm![]() : tensión asimétrica, 3652 cm
: tensión asimétrica, 3652 cm![]() : tensión simétrica, 1595
cm
: tensión simétrica, 1595
cm![]() : flexión.
: flexión.
Solución:
Solución:
Solución:
Solución: (a)
Solución:
Solución:
Solución:
Solución:
Solución: (b)