Aplicaciones de la Química Cuántica.
3ª de Químicas. Convocatoria de Febrero (21 de enero de 2008). Curso 2007-08.
Examen de teoría.
1 [2.0 puntos] Al sustituir H por D en la molécula de fluoruro de hidrógeno, su energía de disociación D0 aumenta ¿Es correcta esta afirmación? Explica detalladamente tu respuesta.
2 [2.0 puntos] ¿Cómo distinguirías de una manera sencilla mediante un método espectroscópico si una muestra de oxígeno contiene ozono?
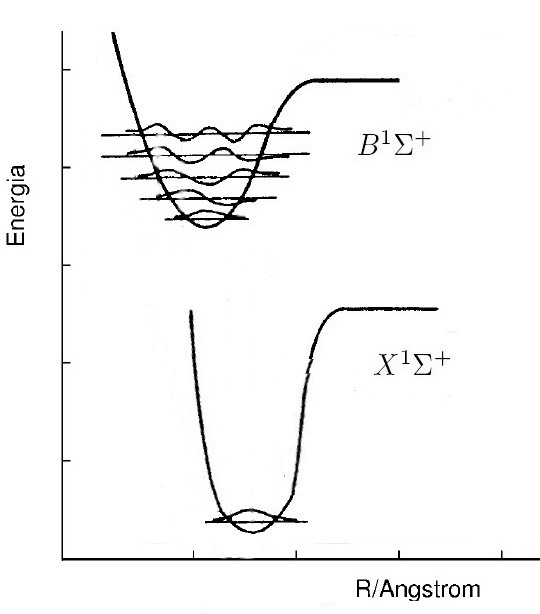 3 [3.0 puntos] Sea la molécula A2 cuyos estados electrónicos
fundamental y excitado se indican en la Figura. a) Indica si la estructura fina de la banda 0-0 se degrada al rojo o al violeta y por qué. b) ¿Qué estado de
los dos tiene mayor ke y por qué? c) ¿Qué estado de los dos tiene mayor De y por qué? d) ¿Cómo sería su
espectro de microondas?
3 [3.0 puntos] Sea la molécula A2 cuyos estados electrónicos
fundamental y excitado se indican en la Figura. a) Indica si la estructura fina de la banda 0-0 se degrada al rojo o al violeta y por qué. b) ¿Qué estado de
los dos tiene mayor ke y por qué? c) ¿Qué estado de los dos tiene mayor De y por qué? d) ¿Cómo sería su
espectro de microondas?
4 [2.0 puntos ] Cierto radical tiene como estado fundamental un estado doblete y experimenta una transición electrónica. ¿Cuál será la multiplicidad de los estados excitados desde los que se pueda producir fluorescencia? ¿Y la de aquéllos que pueden producir fosforescencia?
Examen de problemas
l. [7.0 puntos] En el espectro de infrarrojo del 12C16O se observan dos bandas seguidas que contienen las siguientes líneas consecutivas (en cm-1):
2119.68, 2123.70, 2127.68, 2131.63, 2135.55, 2139.43, 2147.08, 2150.86, 2154.60, 2158.30, 2161.97, 2165.60, 2169.20
4235.95, 4240.14, 4244.26, 4248.32, 4252.30, 4256.22, 4263.84, 4267.54, 4271.18, 4274.74, 4278.24, 4281.65, 4285.01.
a) Asignar los valores de los números cuánticos vibracional y rotacional que corresponden a cada transición
b) Determinar los valores de Bv” , Bv’ , Be y αe
c) Determinar la constante de anarmonicidad
d) Determinar la energía de disociación De y la constante de fuerza del enlace.
e) Calcular la longitud de enlace de equilibrio para la molécula de CO
2 [4.0 puntos] En el espectro electrónico de absorción de la molécula de 7Li2 se observan los siguientes orígenes de bandas (en cm-1):
(0 → 0) = 14014; (0 → 1) = 14279; 0→ 2 = 14541
Determinar los valores de we’, we’xe’, De’ y D0’
Sabiendo que el estado fundamental disocia en dos átomos de Li en su estado fundamental 2S, que el estado excitado, disocia en Li (2S) + Li(2P) y que el Li(2P) se encuentra a 178.28 kJ/mol por encima del Li (2S), calcular el valor de la energía de disociación del Li2 en su estado fundamental.
Datos y constantes::
Na = 6.02214 1023 mol-1; h= 6.62608 10-34 J.s
; c = 2.99792 108 m/s ; 0 oC = 273.15 K ; e = 1.6021773 10-19 C; k = 1.38066 10-23 J/K ; 1
Å= 10-10 m ; m(16O) = 15.99491 uma ; m (12C)
= 12.00000 uma ; m (7Li) = 7.01600 uma.