Aplicaciones de la Química Cuántica.
3ª de Químicas. Convocatoria de Febrero (21 de enero de 2008). Curso 2007-08.
Examen de problemas
l. [7.0 puntos] En el espectro de infrarrojo del 12C16O se observan dos bandas seguidas que contienen las siguientes líneas consecutivas (en cm-1):
2119.68, 2123.70, 2127.68, 2131.63, 2135.55, 2139.43, 2147.08, 2150.86, 2154.60, 2158.30, 2161.97, 2165.60, 2169.20
4235.95, 4240.14, 4244.26, 4248.32, 4252.30, 4256.22, 4263.84, 4267.54, 4271.18, 4274.74, 4278.24, 4281.65, 4285.01.
a) Asignar los valores de los números cuánticos vibracional y rotacional que corresponden a cada transición
b) Determinar los valores de Bv” , Bv’ , Be y αe
c) Determinar la constante de anarmonicidad
d) Determinar la energía de disociación De y la constante de fuerza del enlace.
e) Calcular la longitud de enlace de equilibrio para la molécula de CO
2 [4.0 puntos] En el espectro electrónico de absorción de la molécula de 7Li2 se observan los siguientes orígenes de bandas (en cm-1):
(0 → 0) = 14014; (0 → 1) = 14279; 0→ 2 = 14541
Determinar los valores de we’, we’xe’, De’ y D0’
Sabiendo que el estado fundamental disocia en dos átomos de Li en su estado fundamental 2S, que el estado excitado, disocia en Li (2S) + Li(2P) y que el Li(2P) se encuentra a 178.28 kJ/mol por encima del Li (2S), calcular el valor de la energía de disociación del Li2 en su estado fundamental.
Datos y constantes::
Na = 6.02214 1023 mol-1; h= 6.62608 10-34 J.s
; c = 2.99792 108 m/s ; 0 oC = 273.15 K ; e = 1.6021773 10-19 C; k = 1.38066 10-23 J/K ; 1
Å= 10-10 m ; m(16O) = 15.99491 uma ; m (12C)
= 12.00000 uma ; m (7Li) = 7.01600 uma.
Examen de teoría.
1 [2.0 puntos] Al sustituir H por D en la molécula de fluoruro de hidrógeno, su energía de disociación D0 aumenta ¿Es correcta esta afirmación? Explica detalladamente tu respuesta.
2 [2.0 puntos] ¿Cómo distinguirías de una manera sencilla mediante un método espectroscópico si una muestra de oxígeno contiene ozono?
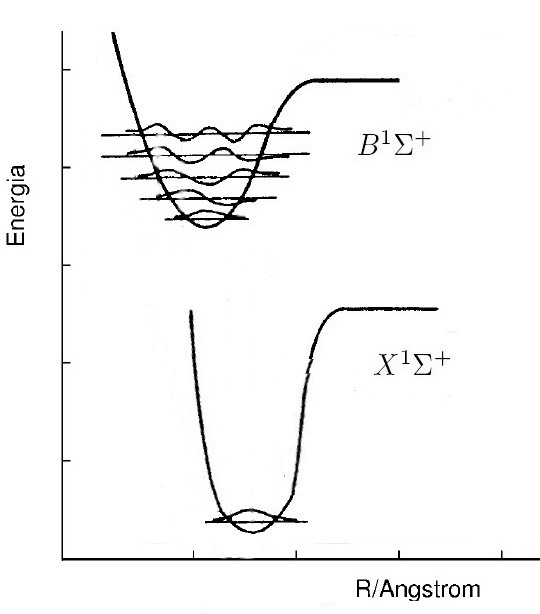 3 [3.0 puntos] Sea la molécula A2 cuyos estados electrónicos
fundamental y excitado se indican en la Figura. a) Indica si la estructura fina de la banda 0-0 se degrada al rojo o al violeta y por qué. b) ¿Qué estado de
los dos tiene mayor ke y por qué? c) ¿Qué estado de los dos tiene mayor De y por qué? d) ¿Cómo sería su
espectro de microondas?
3 [3.0 puntos] Sea la molécula A2 cuyos estados electrónicos
fundamental y excitado se indican en la Figura. a) Indica si la estructura fina de la banda 0-0 se degrada al rojo o al violeta y por qué. b) ¿Qué estado de
los dos tiene mayor ke y por qué? c) ¿Qué estado de los dos tiene mayor De y por qué? d) ¿Cómo sería su
espectro de microondas?
4 [2.0 puntos ] Cierto radical tiene como estado fundamental un estado doblete y experimenta una transición electrónica. ¿Cuál será la multiplicidad de los estados excitados desde los que se pueda producir fluorescencia? ¿Y la de aquéllos que pueden producir fosforescencia?